Электроизвлечение — это очень удобный и надежный способ непосредственного извлечения растворенных металлов, таких как медь, серебро, золото, никель, кобальт и олово, из их водного состояния в определенном электролите. Поэтому неудивительно, что, говоря о рекуперации металлов, мы уделяем основное внимание интересующим нас металлам с целью извлечения их из раствора. В конце концов, именно в этом и заключается цель процесса восстановления металлов. Однако реже говорят о примесях, которые могут повлиять на восстановление металла при электроотжиме. В этом сообщении в блоге будут указаны наиболее вредные примеси и обсуждено их влияние на электроизвлечение некоторых обычно извлекаемых металлов из водных растворов.

Железо как железо (Fe)3+3) Ион
При извлечении недрагоценных металлов, таких как медь, никель, кобальт, а также олово, а также драгоценные металлы, такие как золото и серебро, железо может быть серьезной проблемой, и его можно не учитывать при рассмотрении химического состава процесса. В водных растворах окисленные частицы железа могут присутствовать в виде железа (Fe)2+) и/или железо (Fe)3+3) ионы. В электрохимической ячейке железо может быть проблематично из-за окислительно-восстановительной пары железо/железо.
На аноде железо (Fe)2+) ион окисляется до железа (Fe)3+) ион за счет потери электрона (e-):
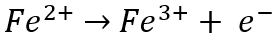
Между тем, на катоде железо (Fe)3+) ион восстанавливается до железа (Fe)2+) ион, получив электрон:
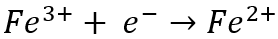
Хотя эти реакции, по-видимому, уравновешивают друг друга, на самом деле они потребляют электричество и пагубно влияют на эффективность тока. Текущий КПД — это фактическое количество извлеченного металла, деленное на теоретическое количество, которое должно было быть извлечено в соответствии с законом Фарадея. Наиболее существенные эксплуатационные затраты, связанные с электроизвлечением, связаны с энергопотреблением, поэтому любая реакция, конкурирующая с реакцией извлечения первичного металла, нежелательна, поскольку она снижает эффективность тока.
В случае электроизвлечения меди предпочтительной реакцией на катоде является:
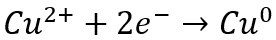
Если вместе с ионом меди в растворе присутствует значительное количество ионов железа, окислительно-восстановительная пара железа и железа будет потреблять электроэнергию и снижать эффективность извлечения меди. По этой причине, как правило, мы обычно рекомендуем использовать соотношение меди и железа более шести, чтобы окислительно-восстановительные пары железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железо-железистые соединения Если соотношение меди и железа меньше шести, может потребоваться этап удаления железа, такой как осаждение, экстракция растворителем (SX) или ионный обмен (IX).

Хлорид
Другой примесью, которая может быть очень проблематичной для извлечения металлов методом электроизвлечения из водных растворов, является хлорид. Хлорид является распространенной примесью, которая в относительно высоких концентрациях содержится как в твердых, так и в водных исходных материалах. Проблема с хлоридом двоякая. С одной стороны, сам хлорид вызывает коррозию и вызывает коррозию смачиваемых деталей из нержавеющей стали, особенно при концентрациях, превышающих 1 г/л в электровыигрышные системы, включая электроды, катод часто изготавливается из нержавеющей стали. В присутствии хлорида на катодах из нержавеющей стали и других смачиваемых деталях из нержавеющей стали начинают образовываться отверстия, которые со временем подвергнутся коррозии до такой степени, что их придется заменить. Это сокращает срок службы оборудования и способствует увеличению расходов на техническое обслуживание и замену. Другая проблема хлорида заключается в том, что он окисляется на аноде с образованием газообразного хлора в результате следующей реакции:
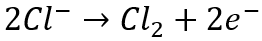
Газообразный хлор чрезвычайно токсичен и вызывает коррозию, поэтому очень важно свести к минимуму образование этого газа в электровыигрышных ячейках во время восстановления металла.
Как правило, мы рекомендуем поддерживать уровень хлорида ниже 50 ppm, чтобы минимизировать коррозию и образование хлора. В более высоких концентрациях для смачиваемых деталей, включая катод, можно использовать коррозионностойкие материалы, такие как титан.
Фторид и бромид
Для извлечения металлов из кислых электролитов, электровыигрышные системы такие как emew, используют аноды, выделяющие кислород, состоящие из титановой подложки с каталитическим покрытием из смешанных оксидов металлов (MMO). Эти аноды MMO очень прочные, но могут быть особенно чувствительны к некоторым примесям, таким как фторид и бромид. Как и в случае с хлоридом, образующим газообразный хлор, фторид и бромид также окисляются на аноде с образованием фтора и брома соответственно. Эти газы чрезвычайно коррозионны и эффективно растворяют титановую подложку, в результате чего покрытие MMO просто разрушается.
Как правило, мы обычно рекомендуем поддерживать уровень фторидов и бромидов ниже 5 ppm, чтобы обеспечить максимальный срок службы анодов MMO, используемых в электровыигрышных ячейках emew.

Органические соединения
Некоторые органические соединения, такие как тиомочевина, клеи и поверхностно-активные вещества, также могут представлять проблемы для анодных покрытий MMO, поскольку они могут окисляться на аноде и прилипать к покрытию. Это может привести к пассивации и преждевременному выходу анода из строя. Сильные хелатирующие агенты, такие как ЭДТА, также могут создавать проблемы, поскольку они могут иметь сильное сродство к оксидам драгоценных металлов, присутствующим в покрытии MMO. Если ЭДТА связывается с оксидами драгоценных металлов, их можно удалить из матрицы и разрушить покрытие MMO.
Если в электролите присутствуют органические вещества, их можно удалить до электроизвлечения с помощью активированного угля или аналогичной предварительной обработки. К сожалению, они могут быть неэффективны для сильных хелатирующих агентов, таких как ЭДТА, поэтому при разработке процесса восстановления металлов важно понять происхождение и химический состав электролита.
Резюме
В целом, извлечение металлов с помощью электролитического извлечения представляет собой очень надежный процесс, который может использоваться в широком диапазоне концентраций, условий эксплуатации и примесей. Есть несколько примесей, которые являются заметными исключениями, и на них следует обратить внимание при оценке применимости процесса восстановления металла к конкретному электролиту. Знание концентраций железа, хлорида, фторида и органических соединений позволит адаптировать процесс извлечения металлов к конкретной матрице раствора и обеспечить эффективное и экономичное извлечение интересующего металла.
У вас есть вопрос о процессе восстановления металла? Свяжитесь с нами!







